臺灣進一步放開干細胞、免疫細胞項目治療!
臺灣衛福部預告《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》修正草案,將開放已證明有初步療效的6項細胞治療,新制最快8月底上路。
衛福部考量病人需求,且鄰近國家如日、韓等國均積極投入細胞治療,決議開放已證明有初步療效的6項治療,以自體細胞使用為優先。
衛福部醫事司長石崇良說,未來醫療機構可依辦法規定,擬具實施計劃,經衛福部核淮登記后,即可讓符合適應癥的病患施行細胞治療。
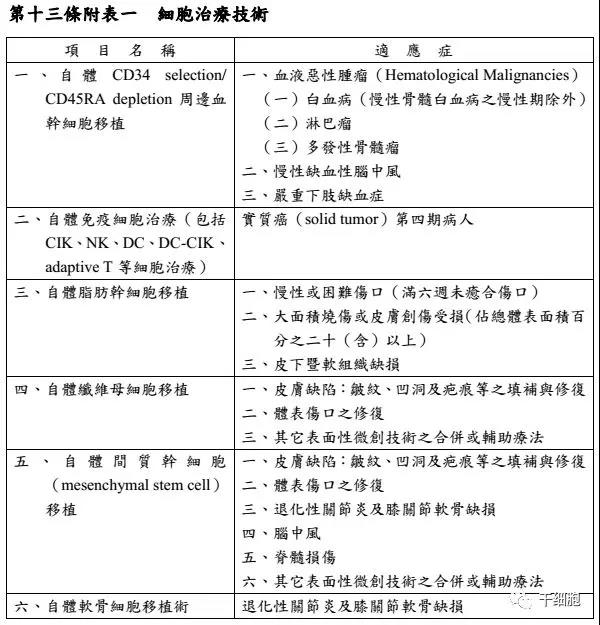
6項細胞治療項目分別為,自體周邊血干細胞移植、自體免疫細胞治療(包括CIK、NK、DC、DC-CIK、adaptive T等細胞治療)、自體脂肪干細胞移植、自體纖維母細胞移植、自體間充質干細胞移植、自體軟骨細胞移植術。
適應癥則分別有白血病、淋巴瘤、多發性骨髓瘤、慢性缺血性腦中風、嚴重下肢缺血、實質癌第四期、大面積燒傷或皮膚創商、體表傷口填補、脊髓損傷、退化性關節炎及膝關節軟骨缺損等。
石崇良說,因治療涉及細胞處理,醫療單位應備有通過人體細胞組織優良操作規范的安全實驗室。為了監督執行效果,也會要求療單位提個案報告結果審查,事后追蹤查核。
因自體細胞治療項目樣態多,石崇良說,為保障患者權益,醫療單位的執行計劃書內需注明施行醫師、實施項目、費用及收費方式,資訊公開透明。且收費應符合成本分析。